Definição: é o grupo de compostos que em solução aquosa se ionizam, produzindo o cátion hidrogênio como íon positivo.
Os ácidos apresentam as propriedades relacionados abaixo:
• Têm sabor azedo. O limão, por exemplo, é azedo porque contém ácidos do cítrico.
• Conduzem bem a eletricidade quando a solução. Por exemplo, para realizar a eletrólise (ou quebra de molécula por corrente elétrica) da água, fazemos passar uma corrente elétrica por uma porção de água acidulada, pois a água pura não é boa condutora de eletricidade.
• Alteram a cor dos indicadores. (Indicadores são substancias que têm a propriedade de mudar de cor; essa mudança de cor indica o caráter ácidos ou básico da solução). Por exemplo, a fenolftaleína vermelha se torna incolor quando a ela é acrescentado um ácido; o papel de tornassol azul fica vermelho quando mergulhado em ácido.
• Reagem com os hidróxido (bases), produzindo sal e água. O ácido clorídrico, por exemplo, reage com o hidróxido de sódio (soda cáustica), formando cloreto de sódio e água. Veja:
HCL + NaOH - NaCL + H2O
ácido + base - sal + água
Os ácidos podem ser classificados em dois grupos: hidrácidos e oxiácidos.
Hidrácidos. Observe a fórmula dos seguintes ácidos: ácido iodídrico, HI; ácido sulfídrico, H2S; ácido clorídrico, HCL.
Observe que esses ácidos não possuem átomos de oxigênio. Os hidrácidos são, portanto, os ácidos que possuem átomos de oxigênio.
Oxiácidos. Considere agora os seguintes ácidos: ácido carbônico, H2CO3; ácido sulfuroso, H2so3; ácido sulfúrico, H2SO; ácido nitroso, HNO2; ácido nítrico, HNO3. Como você pode percebe, esses ácidos apresentam átomos de oxigênio. Os oxiácidos são, portanto, ácidos que possuem átomos de oxigênio.
Químitrônica
segunda-feira, 10 de dezembro de 2012
Função das bases
A denominação das bases é dada pela expressão hidróxido de seguida do nome do elemento.
Portanto, o esquema para escrever o nome das bases é o seguinte:
hidróxido de nome do elemento
Exemplos:
• AL(OH)3 = hidróxido de alumínio;
• KOH = hidróxido de potássio;
• Ca(OH)2 = hidróxido de cálcio.
Um mesmo elemento químico pode dar origem a duas bases. Nesse caso, usamos a terminação:
• oso: para as bases em que for menor a valência do elemento ligado á hidroxila;
• ico: para as bases em que for maior a valência do elemento ligado á hidroxila;
Veja o exemplo:
Fe(oh)2 = hidróxido ferroso
Fe(oh)3 = hidróxido férrico
Podemos também escrever o nome das bases sem a terminação oso ou ico, colocando a valência do elemento em algarismo romano. Veja:
Fe(oh)2 = hidróxido de ferro II
Fe(oh)3 = hidróxido férrico III
Portanto, o esquema para escrever o nome das bases é o seguinte:
hidróxido de nome do elemento
Exemplos:
• AL(OH)3 = hidróxido de alumínio;
• KOH = hidróxido de potássio;
• Ca(OH)2 = hidróxido de cálcio.
Um mesmo elemento químico pode dar origem a duas bases. Nesse caso, usamos a terminação:
• oso: para as bases em que for menor a valência do elemento ligado á hidroxila;
• ico: para as bases em que for maior a valência do elemento ligado á hidroxila;
Veja o exemplo:
Fe(oh)2 = hidróxido ferroso
Fe(oh)3 = hidróxido férrico
Podemos também escrever o nome das bases sem a terminação oso ou ico, colocando a valência do elemento em algarismo romano. Veja:
Fe(oh)2 = hidróxido de ferro II
Fe(oh)3 = hidróxido férrico III
As bases apresentam as propriedades relacionadas a seguir:
• Têm sabor adstringentes.
• conduzem bem a eletricidade, quando em solução.
• Torna vermelha a fenolftaleína incolor.
• Torna azul o papel de tornassol vermelho.
• Reagem com os ácidos, produzindo sal e água. Exemplo: o ácido sulfídrico e a soda cáustica reagem formando sulfeto de sódio e água.
Assim:
H2S + 2NaOH - Na2S + 2H2O
ÁCIDO BASE SAL ÁGUA
• Têm sabor adstringentes.
• conduzem bem a eletricidade, quando em solução.
• Torna vermelha a fenolftaleína incolor.
• Torna azul o papel de tornassol vermelho.
Assim:
H2S + 2NaOH - Na2S + 2H2O
ÁCIDO BASE SAL ÁGUA
Função dos óxidos
Óxidos são compostos binários em que o oxigênio é o elemento mais eletronegativo.
Em um óxido, a ligação entre o oxigênio e outro elemento pode ser iônica ou covalente.- Óxidos iônicos são compostos nos quais o oxigênio está ligado a um metal de baixa eletronegatividade, isto é, alcalinos e alcalinoterrosos, que fornecem elétrons para o oxigênio.
Exemplos: Li2O e MgO
- Óxidos moleculares, ou covalentes, são compostos nos quais o oxigênio está ligado a um elemento de grande eletronegatividade.
Exemplos: CO2 , SO2 e NO.
Nomenclatura dos Óxidos
Nomeamos os óxidos de acordo com os grupos de divisão:
Óxidos moleculares: “óxido de elemento“; antes da palavra óxido e do nome do elemento, colocamos os prefixos mono, di, tri, tetra, penta, etc. para indicar a quantidade de átomos de oxigênio e do elemento existentes na fórmula:
Exemplo:
CO2: dióxido de carbono
Óxidos iônicos: escrevemos a palavra óxido seguida da preposição de e do nome do elemento associado ao oxigênio.
Exemplo:CaO: óxido de cálcio
Caso o elemento, metal, forme dois cátions diferentes, a distinção é feita da mesma forma que para as bases e para os sais:
Exemplo:
FeO: óxido de ferro II ou óxido ferroso
Classificação dos ÓxidosPodemos classificar os óxidos em:Básicos: reagem com água, formando uma base, e reagem com ácidos, formando sal e água. Para formar uma base, é necessário um cátion, portanto estes óxidos são todos iônicos. Exemplo:
K2O + H2O → 2KOH
K2O + 2HCl → 2KCl + H2O
Ácidos: reagem com água, formando ácido, e reagem com base, formando sal e água; estes óxidos são todos moleculares.
Em um óxido, a ligação entre o oxigênio e outro elemento pode ser iônica ou covalente.- Óxidos iônicos são compostos nos quais o oxigênio está ligado a um metal de baixa eletronegatividade, isto é, alcalinos e alcalinoterrosos, que fornecem elétrons para o oxigênio.
Exemplos: Li2O e MgO
- Óxidos moleculares, ou covalentes, são compostos nos quais o oxigênio está ligado a um elemento de grande eletronegatividade.
Exemplos: CO2 , SO2 e NO.
Nomenclatura dos Óxidos
Nomeamos os óxidos de acordo com os grupos de divisão:
Óxidos moleculares: “óxido de elemento“; antes da palavra óxido e do nome do elemento, colocamos os prefixos mono, di, tri, tetra, penta, etc. para indicar a quantidade de átomos de oxigênio e do elemento existentes na fórmula:
Exemplo:
CO2: dióxido de carbono
Óxidos iônicos: escrevemos a palavra óxido seguida da preposição de e do nome do elemento associado ao oxigênio.
Exemplo:CaO: óxido de cálcio
Caso o elemento, metal, forme dois cátions diferentes, a distinção é feita da mesma forma que para as bases e para os sais:
Exemplo:
FeO: óxido de ferro II ou óxido ferroso
Classificação dos ÓxidosPodemos classificar os óxidos em:Básicos: reagem com água, formando uma base, e reagem com ácidos, formando sal e água. Para formar uma base, é necessário um cátion, portanto estes óxidos são todos iônicos. Exemplo:
K2O + H2O → 2KOH
K2O + 2HCl → 2KCl + H2O
Ácidos: reagem com água, formando ácido, e reagem com base, formando sal e água; estes óxidos são todos moleculares.
Exemplos:
SO3 + H2O → H2SO4
SO3 + 2NaOH → Na2SO4 + H2O
Podemos considerar os óxidos ácidos como ácidos que perderam água; por isso eles são também chamados de anidridos (sem água):
Anfóteros: reagem tanto com ácido como com base.
SO3 + H2O → H2SO4
SO3 + 2NaOH → Na2SO4 + H2O
Podemos considerar os óxidos ácidos como ácidos que perderam água; por isso eles são também chamados de anidridos (sem água):
Anfóteros: reagem tanto com ácido como com base.
Exemplos:
Pb, ZnO, Al2O3 …
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2NaOH → Na2ZnO2Neutros ou Indiferentes: não reagem com água, nem com ácido, nem com base.
Pb, ZnO, Al2O3 …
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2NaOH → Na2ZnO2Neutros ou Indiferentes: não reagem com água, nem com ácido, nem com base.
São os óxidos:CO , NO e N2O
domingo, 9 de dezembro de 2012
Ligações metálicas
A ligação metálica (ligação entre metais) não pode ser explicada nem pela ligação covalente nem pela iônica, configurando-se como um tipo específico e diferenciado de ligação entre átomos. Você deve se lembrar que em um sólido os átomos estão muito próximos uns dos outros e que a maioria desses sólidos apresenta os elétrons bem presos aos seus átomos. Mas, na ligação metálica, os elétrons mais externos, por se encontrarem muito distantes do núcleo, movimentam-se livremente, formando um mar de elétrons dentro do retículo cristalino. Sendo assim, podemos definir a ligação metálica como “retículo de esferas rígidas (cátions) mantidas coesas por elétrons que podem se mover livremente – elétrons livres.
Em outras palavras, os metais são formados por um aglomerado de íons cátions mergulhados em uma nuvem ou “mar” de elétrons. A movimentação desses elétrons livres explica a condutividade elétrica e térmica característica dos metais. Quando aquecemos uma barra de metal, promovemos a agitação entre os átomos que as formam, fazendo com que os elétrons aumentem suas oscilações e a energia se propague aos átomos mais internos. Isso acontece porque os elétrons livres se chocam com os átomos mais velozes e aceleram os mais lentos, servindo como meio de propagação de calor. Logo, a condutibilidade (elétrica ou térmica), própria dos metais, depende do número de elétrons livres no cristal.
Ao contrário das ligações covalentes e iônicas, a ligação metálica não tem representação eletrônica. Por isso, os metais são representados por seus símbolos, sem indicação do número de átomos envolvidos, já que esta quantidade é muito grande e indeterminada. Exemplos: Fe, Cu, Na, Ag, Au, Ca, Hg, Mg, Cs, Li.
*Propriedades dos metais:
- Alta condutividade elétrica e térmica;
- Alta maleabilidade e alta ductibilidade;
- Altos pontos de fusão e ebulição;
- Bilho metálico (com exceção do cobre e do ouro, que têm cor avermelhada e dourada, respectivamente).
*Os metais são encontrados na natureza no estado sólido, com exceção do mercúrio, que é encontrado no estado líquido;
**Poucos são os metais encontrados puros na natureza, entre eles estão o ouro, a prata, a platina e o bismuto. Os demais são encontrados em forma de compostos, sendo os mais comuns os óxidos. O metal ferro, por exemplo, é retirado do minério de ferro hematita, que é uma combinação com oxigênio.
***Atenção: os metais só conduzem eletrecidade se estiverem no estado sólido ou líquido (metal fundido).
Exemplo da ligação metálica:
sexta-feira, 7 de dezembro de 2012
Ligação covalente normal
Definição:
É realizada de acordo com a diferença de eletronegatividade. Geralmente, ocorre entre um não-metal e não-metal, hidrogênio e não-metal e hidrogênio com hidrogênio.
Esta ligação é caracterizada pelo compartilhamento de elétrons entre os átomos. O hidrogênio possui um elétron na sua camada de valência. Para ficar idêntico ao gás nobre hélio com 2 elétrons na última camada. Ele precisa de mais um elétron. Então, 2 átomos de hidrogênio compartilham seus elétrons ficando estáveis:
Ex. H (Z = 1) K = 1
O traço representa o par de elétrons compartilhados.
Nessa situação, tudo se passa como se cada átomo tivesse 2 elétrons em sua eletrosfera. Os elétrons pertencem ao mesmo tempo, aos dois átomos, ou seja, os dois átomos compartilham os 2 elétrons. A menor porção de uma substância resultante de ligação covalente é chamada de molécula. Então o H2 é uma molécula ou um composto molecular. Um composto é considerado composto molecular ou molécula quando possui apenas ligações covalentes
Observe a ligação covalente entre dois átomos de cloro:
 Fórmula de Lewis ou Fórmula Eletrônica Fórmula de Lewis ou Fórmula Eletrônica
Fórmula Estrutural
Fórmula Molecular
Conforme o número de elétrons que os átomos compartilham, eles podem ser mono, bi, tri ou tetravalentes.
A ligação covalente pode ocorrer também, entre átomos de diferentes elementos, por exemplo, a água.
 Fórmula de Lewis Fórmula de Lewis
Fonte: plataovag.blogspot.com
|
quinta-feira, 6 de dezembro de 2012
Ligação iônica
Definição: é um tipo de ligação entre os átomos que se dá por meio da atração eletrostática entre íons de cargas opostas. Nesta ligação sempre haverá um átomo que perde elétron(s) enquanto outro ganha elétron(s), isto é, só haverá ligação iônica quando um elemento precisar um ou mais elétrons e o outro precisar perder um ou mais elétrons.
Observe que os metais têm menos de 4 elétrons na última camada da sua eletrosfera. Sendo assim, para que esses elementos possam ficar estáveis (com 8 elétrons na última camada), eles teriam que ganhar mais de 4 elétrons ou, muito mais fácil, perder menos de 4. É claro que a tendência é que esses átomos percam os seus menos de 4 elétrons da camada de valência. É por isso que, sobre os metais, dizemos que eles têm facilidade em ceder elétrons, formando íons de carga positiva (cátions), fato este que nos leva a concluir que os metais têm alta eletropositividade. Observe agora o número de elétrons na última camada dos ametais (não metais). Você verá que os ametais têm mais de 4 elétrons na camada de valência. Para ficarem estáveis, completando os 8 elétrons de sua última camada, os ametais devem receber, ganhar, os elétrons que faltam. Por terem facilidade em receber elétrons, formando íons de carga negativa (ânions), dizemos que os ametais têm alta eletronegatividade.
Veja o seguinte exemplo:
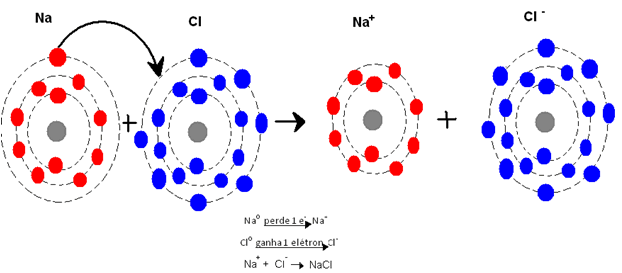
Se os metais precisam doar de 1 a 3 elétrons para ficarem estáveis, e se os ametais precisam receber de 1 a 3 elétrons para alcançarem a tão almejada posição de estabilidade, o que pode acontecer entre eles? Pois é, juntou a fome com a vontade de comer, o útil com o agradabilíssimo! Se eu preciso me livrar do jiló do meu prato, e se você deseja loucamente comer jiló (tem gosto pra tudo!), então estamos vantajosamente ligados pelo destino.
É bem isso que ocorre com os metais e ametais. Ambos se ligam em compostos iônicos por meio da atração eletrostática. Podemos dizer, então, que a ligação iônica é um tipo de ligação química, de natureza eletrostática, que ocorre entre metais e ametais com transferência de elétrons.
Uma das formas que temos para representar a ligação química é pelo Diagrama de Lewis, por meio do qual os elétrons da camada de valência são representados por pontos ao redor do símbolo do elemento. Exemplo:
Cloreto de potássio
Potássio (K): Z = 19
K (2), L (8), M (8), N (1)
Cloro (Cl): Z = 17
K (2), L (8), M (7)
Representação (Lewis):

terça-feira, 4 de dezembro de 2012
Ligação covalente dativa
Ligação covalente dativa ocorre quando um átomo compartilha seus elétrons. Essa ligação obedece à Teoria do Octeto, onde os átomos se unem tentando adquirir oito elétrons na camada de valência para atingir a estabilidade eletrônica. 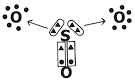
A ligação covalente se dá entre elementos eletronegativos, que têm a tendência de ganhar elétrons, por meio do compartilhamento de pares eletrônicos. Desse modo, os elementos envolvidos ficam estáveis, pois completam seu octeto eletrônico, ou seja, ficam com oito elétrons na camada de valência e adquirem configuração de gás nobre.
No entanto, existem alguns casos em que um dos átomos envolvidos já adquiriu estabilidade enquanto que outro átomo participante da ligação ainda necessita de dois elétrons para completar sua camada de valência. Desse modo, o átomo, já estável, compartilha um par de elétrons com o outro átomo ainda instável.
Nesse caso, é uma ligação covalente, por haver compartilhamento de elétrons e por não haver formação de íons, pois não há transferência definitiva desses elétrons. Porém, não se trata de uma ligação covalente comum, porque a ligação não ocorre com um elétron proveniente de cada átomo, mas sim com os elétrons de um único átomo que já estava estável.
Assinar:
Comentários (Atom)
 Fórmula Estrutural
Fórmula Estrutural