Definição: é um tipo de ligação entre os átomos que se dá por meio da atração eletrostática entre íons de cargas opostas. Nesta ligação sempre haverá um átomo que perde elétron(s) enquanto outro ganha elétron(s), isto é, só haverá ligação iônica quando um elemento precisar um ou mais elétrons e o outro precisar perder um ou mais elétrons.
Observe que os metais têm menos de 4 elétrons na última camada da sua eletrosfera. Sendo assim, para que esses elementos possam ficar estáveis (com 8 elétrons na última camada), eles teriam que ganhar mais de 4 elétrons ou, muito mais fácil, perder menos de 4. É claro que a tendência é que esses átomos percam os seus menos de 4 elétrons da camada de valência. É por isso que, sobre os metais, dizemos que eles têm facilidade em ceder elétrons, formando íons de carga positiva (cátions), fato este que nos leva a concluir que os metais têm alta eletropositividade. Observe agora o número de elétrons na última camada dos ametais (não metais). Você verá que os ametais têm mais de 4 elétrons na camada de valência. Para ficarem estáveis, completando os 8 elétrons de sua última camada, os ametais devem receber, ganhar, os elétrons que faltam. Por terem facilidade em receber elétrons, formando íons de carga negativa (ânions), dizemos que os ametais têm alta eletronegatividade.
Veja o seguinte exemplo:
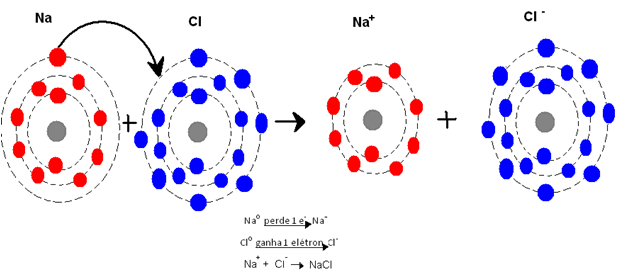
Se os metais precisam doar de 1 a 3 elétrons para ficarem estáveis, e se os ametais precisam receber de 1 a 3 elétrons para alcançarem a tão almejada posição de estabilidade, o que pode acontecer entre eles? Pois é, juntou a fome com a vontade de comer, o útil com o agradabilíssimo! Se eu preciso me livrar do jiló do meu prato, e se você deseja loucamente comer jiló (tem gosto pra tudo!), então estamos vantajosamente ligados pelo destino.
É bem isso que ocorre com os metais e ametais. Ambos se ligam em compostos iônicos por meio da atração eletrostática. Podemos dizer, então, que a ligação iônica é um tipo de ligação química, de natureza eletrostática, que ocorre entre metais e ametais com transferência de elétrons.
Uma das formas que temos para representar a ligação química é pelo Diagrama de Lewis, por meio do qual os elétrons da camada de valência são representados por pontos ao redor do símbolo do elemento. Exemplo:
Cloreto de potássio
Potássio (K): Z = 19
K (2), L (8), M (8), N (1)
Cloro (Cl): Z = 17
K (2), L (8), M (7)
Representação (Lewis):

Nenhum comentário:
Postar um comentário